総説論文 Why do we respond so differently? Reviewing determinants of human salivary cortisol responses to challenge Author links open overlay panelBrigitte M. Kudielka a b , D.H. Hellhammer b, Stefan Wüst b c Psychoneuroendocrinology Volume 34, Issue 1, January 2009, Pages 2-18 Psychoneuroendocrinology を、Google NoteBookLMの音声概要作成機能を利用して、わかりやすく解説してもらいました。
投稿者「PhD」のアーカイブ
研究の未来:生成AIが拓く新たなフロンティア
Gemini Deep Research 2025年10月23日
研究の未来:生成AIが拓く新たなフロンティア
第1章 科学的発見の新たなパラダイム
生成AI(人工知能)の台頭は、科学研究の方法論に根本的な変革をもたらしている。単なる効率化ツールという位置づけを超え、科学的探究の様式そのものを再定義する触媒として機能し始めている。本章では、生成AIがもたらすこのパラダイムシフトの核心、すなわち、偶然による発見から設計による発見への移行、研究ライフサイクルの劇的な圧縮、そして人間の直感を拡張する「セレンディピティ・エンジン」としてのAIの役割について論じる。
1.1 偶然による発見から設計による発見へ:根本的シフト
伝統的な研究開発は、時間、コスト、そして人間の認知能力という三重の制約に縛られてきた 1。例えば、新薬開発には通常10年から15年の歳月と数十億ドルの費用を要する 1。次世代バッテリーやグリーン水素のための新素材開発もまた、時間のかかる不確実なプロセスであった 1。
生成AIは、この方程式を根本から書き換える。AIモデルは、科学論文、実験結果、分子構造といった、人類が蓄積してきた膨大なデータを学習し、未知の物質がどのように振る舞うか、タンパク質がどのように折りたたまれるか、さらには惑星がどのように進化するかを予測する能力を獲得した 1。かつて何年もの試行錯誤を要したプロセスが、今や数週間のシミュレーション、検証、反復作業に圧縮されつつある 1。これは、単なる量的変化ではなく、「偶然による発見(discovery by chance)」から「設計による発見(discovery by design)」への質的転換を意味する 1。この新しいパラダイムは、発見そのものの定義を問い直し、「仮説と証明の間の距離」を劇的に縮めている 1。
この変化は、科学的仮説の性質そのものを変容させる。伝統的に、仮説は研究者の深い専門知識と直感から生まれる、検証可能な具体的な命題であった。しかし、AIが生成する仮説は、しばしば単一の人間の専門家では把握しきれない広範なマルチモーダルデータから特定された高確率のパターンであり、その根拠は計算論的に導出される。例えば、FRONTEO社の創薬支援プラットフォームは、数千万報以上の論文を解析し、疾患と標的分子の未知の関連性を示唆する仮説を生成する 2。これは教育された推測ではなく、データ駆動型の命題である。さらに、AUTODSのようなシステムは、人間の指示を待たずにデータ内の「驚き」を探求することで、自律的に仮説を生成するよう設計されている 5。これにより、仮説はもはや人間の創造性の産物であるだけでなく、複雑なデータエコシステムからアルゴリズムによってキュレーションされる創発的な特性となり得る。その結果、研究者の知的貢献の重心は、仮説を立てる「もし~だとしたら?」という問いから、AIが提示した仮説を検証し、その意味を解釈する「これは何を意味するのか?」という問いへとシフトしていく。
1.2 仮説から証明までのライフサイクルの圧縮
AIによる研究プロセスの加速は、単なる理論上の可能性ではない。すでに様々な分野で定量的な成果として現れている。
生命科学の分野では、香港を拠点とするInsilico Medicine社が、AIを用いて特発性肺線維症の治療薬候補を設計し、臨床試験(第II相)開始までを30ヶ月未満で達成した 1。これは、従来の10年以上に及ぶ開発期間を大幅に短縮する画期的な事例である。同様に、Moderna社とBioNTech社は、AIを活用してmRNAワクチンの配列を数週間で最適化し、COVID-19パンデミックへの迅速な対応に貢献した 1。
材料科学の分野でも、この加速は顕著である。ローレンス・バークレー国立研究所の自律実験施設「A-Lab」は、AIによるハイスループット計算と自律合成を組み合わせることで、新素材発見のサイクルを数十年から数ヶ月へと圧縮している 1。これらの事例が示すのは、単なる漸進的な改善ではなく、科学的進歩の速度における相転移である。
1.3 「セレンディピティ・エンジン」としてのAI:人間の直感の拡張
生成AIは、既知の情報を整理・要約するだけでなく、新規性と驚きを生み出すツールとしての可能性を秘めている。自律的に研究テーマを発見するAIシステム「AUTODS」は、データ内の「驚き」を定量化し、それを基に人間が指示していない仮説を自ら生成する 5。これは、AIの役割が従来の「仮説検証」ツールから、新たな知の探求を促す「仮説生成」エンジンへと進化していることを示している 4。
この能力により、AIは一種の「セレンディピティ・エンジン」として機能する。認知バイアスや専門分野の壁によって人間が見過ごしがちなデータのパターンや、既存の知識体系における矛盾点を体系的に指摘することができる 5。これにより、予期せぬ発見の機会が創出され、研究者の役割も変化する。創造性の唯一の源泉であるという立場から、AIが生成した無数の「驚くべき発見の候補」の中から真に価値のあるものを見極め、文脈を与え、より深い洞察へと昇華させる「最終的な審判者であり、物語の紡ぎ手」へとシフトしていくのである 5。AIが膨大な数の手がかりを生成し、人間がその中から本質的な発見を選び出し、科学的な物語として完成させる。この人間とAIの協業は、科学の進歩を飛躍的に加速させる可能性を秘めている。
第2章 研究ライフサイクルの増強:プロセスベースの分析
生成AIは、研究プロセスの各段階に深く浸透し、従来の手法を根本から変えつつある。本章では、研究プロセスを文献調査、仮説生成、実験計画・実行、データ分析・解釈、そして論文執筆・発信の5つの段階に分解し、それぞれの段階で生成AIツールがどのように活用され、研究者の能力を増強しているかを具体的に分析する。
表1:現代の研究者のための生成AIツールキット
| 研究段階 | ツールカテゴリ | 具体的なツール(例) | 主要機能 | 典拠 |
| 文献調査・統合 | AIリサーチアシスタント | Elicit, Consensus, Scite, Enago Read, Scholarcy, ResearchRabbit, Connected Papers | 論文の要約、関連性の発見、コンセプトマップ作成、研究動向の可視化 | 6 |
| 仮説生成 | AI発見プラットフォーム | FRONTEO Drug Discovery AI Factory, AUTODS | 膨大なデータセットから新規性の高い関連性や研究課題を特定 | 2 |
| 実験計画 | AI最適化エージェント | Ax, BoTorch, Gryffin, Taskade Agent | パラメータ最適化、結果のシミュレーション、効率的な実験デザインの提案 | 12 |
| データ分析 | AI搭載分析ツール | ChatGPT Advanced Data Analysis, Copilot in Excel, Gemini | 自然言語プロンプトによるデータ分析、可視化、パターン特定 | 16 |
| 執筆・発信 | AIライティングアシスタント | Paperpal, Grammarly, QuillBot, Zotero | ドラフト作成、パラフレーズ、文法チェック、引用フォーマット | 10 |
2.1 文献調査・統合:情報の洪水を手なずける
現代の研究者は、日々発表される膨大な量の論文によって引き起こされる「情報の洪水」や「知の迷路」に直面しており、最新の動向を把握することが極めて困難になっている 6。生成AIは、この課題に対処するための強力な武器となる。
Enago ReadやScholarcy、Paper Digestといったツールは、論文の要約や重要ポイントの抽出を自動化し、研究者が文献の読み込みに費やす時間を劇的に短縮する 6。これにより、従来数時間から数日かかっていた情報整理が、数分から数十分で完了する時代が到来した 9。
さらに進んだツールとして、ElicitやConsensusは、研究者が投げかけたリサーチ・クエスチョンに対し、複数の関連論文から知見を抽出し、手法、データサイズ、結論などを比較可能な表形式で要約する 7。これにより、読むべき論文の優先順位付けや、特定テーマに対する研究コミュニティの意見分布(賛成・反対の比率など)を迅速に把握できる 9。
また、ResearchRabbit、Connected Papers、Litmapsのような文献マッピングツールは、論文間の引用関係や類似性に基づき、学術的なつながりをネットワーク図として視覚化する 7。これにより、研究者は自身の研究分野における重要な論文や新たな研究の潮流を直感的に理解し、次に読むべき論文を効率的に見つけ出すことが可能になる 7。
2.2 仮説生成:人間の認知を超える
この段階は、単なる効率化から真の発見へと飛躍する、生成AIの最も革新的な応用領域の一つである。AIは既知の情報を要約するだけでなく、未知の真実を提案する能力を持つ。
ケーススタディ:FRONTEOのDrug Discovery AI Factory
このプラットフォームは、自社開発の自然言語処理(NLP)エンジン「KIBIT」を用いて、PubMedに収録されている3000万報以上の文献情報を解析し、創薬ターゲット、ドラッグ・リポジショニング、疾患メカニズムに関する新規性の高い仮説を生成する 2。特筆すべきは、特定の疾患に関連する遺伝子ネットワーク全体をわずか10分で描き出す能力であり、これは人間には到底不可能な規模の解析である 4。
このようなプロセスは、最良の説明へと至る創造的・直感的な飛躍を伴う「アブダクション的推論」と関連付けられる 24。AIには真の直感はないが、データ内に存在する最も確率が高い、しかし自明ではない関連性を特定することで、このプロセスをシミュレートする。研究者は、AIが提示した仮説を批判的に吟味し、検証することで、新たな発見への道を切り拓くことができる 24。
2.3 実験計画・実行:自律実験室の夜明け
AIは、手作業による試行錯誤が中心だった実験プロセスを、最適化された自律的なプロセスへと変革している。この変革の核心にあるのは、個々の研究ステップの自動化ではなく、それらを統合し、仮説、実験、分析のサイクルを自律的に回す「クローズドループ」システムの構築である。
個々のAIツールは、文献調査 7、実験計画 12、データ分析 16 といった線形のプロセスを効率化する。しかし、最も深遠な変革は、これらの要素を統合することによってもたらされる。「自律実験室(Self-driving lab)」は、計算論的モデリングと物理的実験の間の「ループを閉じる」ことを明確な目的として設計されている 25。AIは各実験から学習し、次の実験を自ら決定する 27。
マサチューセッツ工科大学(MIT)のCREStプラットフォームは、AI駆動のロボットアームを用いて化学実験を提案・実行し、研究者が次に進むべきステップをガイドすることで、この概念を具体化している 1。同様に、トロント大学のChemOSはモジュール式の自動化によって材料発見を加速させている 1。これらのシステムは、研究パラダイムを、人間が主導する逐次的なプロセスから、機械が主導する反復的なサイクルへと転換させる。人間の役割は、オペレーターから、全体的な目標を設定し、必要に応じて介入する監督者へとシフトする。これは、科学の方法論そのものの根本的な変化である。
AIによる実験計画
AIエージェントは、実験設定を分析し、改善案を提案し、結果をシミュレーションし、重要な変数を特定することができる 12。特に、**ベイズ最適化(Bayesian Optimization)**のような手法は、グリッドサーチなどの従来法よりも少ない試行回数で、関数の大域的最適解(例えば、最良の材料特性)を効率的に見つけ出すために用いられる 13。これは、可能性の組み合わせが膨大となる材料科学のような高次元空間において極めて重要である 29。
自律実験室(Self-driving Labs)
これはAIによる実験計画の物理的な具現化である。これらの実験室は、AI、ロボティクス、そしてクローズドループ実験を統合し、24時間365日、自律的に実験を計画、実行、改良する 1。製薬業界では研究開発サイクルを500日以上短縮し、材料科学では数万通りの組み合わせを数週間でスクリーニングすることが可能になる 27。日本でも、薄膜材料を自律的に合成するシステムの開発が進められている 26。
2.4 データ分析・解釈:洞察の民主化
生成AIは、複雑なデータ分析の参入障壁を劇的に下げている。ChatGPTのAdvanced Data Analysis(旧Code Interpreter)やMicrosoft Copilot in Excelといったツールは、研究者が自然言語のプロンプト(指示文)を用いるだけで、高度な統計分析、データの可視化、傾向の特定などを実行することを可能にする 16。
これにより、高度なプログラミングスキルを持たないドメイン専門家でも、自身のデータをより深く、効果的に探求できるようになり、データサイエンスが民主化される 20。AIは、データのクレンジングや構造化、さらには適切な分析モデルの提案といった前処理も自動で実行できる 18。
生成AIの最大の利点は、人間が大規模で複雑なデータセットの中から見逃しがちな「予期せぬパターン」や洞察を発見する能力にある 16。
2.5 執筆・発信:学術的協力者としてのAI
AIツールは、学術論文の執筆プロセスにおいても不可欠な存在となりつつある。アウトラインの生成、セクションのドラフト作成、学術的なトーンを維持するためのパラフレーズなどを支援する 10。
PaperpalやGrammarlyは高度な英文法チェック機能を提供し、QuillBotは文章の言い換えを支援する 10。また、ZoteroやEndNoteのような文献管理ツールは引用フォーマットを自動化し、Consensus GPTは特定の主張を裏付けるための関連文献を効率的に探し出す 10。
しかし、極めて重要な注意点がある。これらのツールはあくまで補助的なものであり、著者に取って代わるものではない。研究成果の知的貢献、正確性、そして物語性に対する最終的な責任は、常に人間の研究者が負うものである 21。
第3章 実践における生成AI:分野横断的サーベイ
生成AIがもたらす変革は、特定の研究分野に限定されるものではない。生命科学から人文科学に至るまで、あらゆる学術領域でその影響が具体化し始めている。本章では、分野横断的な視点から、生成AIが現実世界でどのように活用され、科学的発見を加速させているかの具体的な事例を概観する。
3.1 生命科学・医学:治療法への道を加速する
生命科学は、生成AIのインパクトが最も劇的に現れている分野の一つである。
- 創薬(Drug Discovery):AIは創薬プロセスを根底から覆している。
- Insilico Medicine社は、AIのみを用いて発見した特発性肺線維症の治療薬候補を、世界で初めて臨床試験(第II相)へと進めた 1。
- フランスのIktos社や日本のFRONTEO社は、生成モデルを用いてゼロから新しい化合物を設計する「de novo創薬」や、膨大な文献データに基づく仮説生成に取り組んでいる 2。
- タンパク質構造予測:DeepMind社が開発したAlphaFoldは、生物学における50年来の難問であったタンパク質の立体構造予測問題を解決した 1。このブレークスルーは、特定のタンパク質が関与する疾患の治療法開発、酵素設計、ワクチン開発を飛躍的に加速させるものである。
- ゲノミクス:AIは、膨大な遺伝子データセットを解析し、疾患マーカーの特定や遺伝子変異がもたらす影響の予測に活用されている。カナダのDeep Genomics社は、AIプラットフォームを用いてRNAベースの治療法を発見している 2。
- 医療画像:生成AIは、高品質な合成医療画像(CTスキャン、MRIなど)を生成することができる 32。これにより、希少疾患などで不足しがちな学習データを補い、診断モデルの精度を向上させることが可能になる。
これらの進展は、計算論的研究(ドライラボ)と実験的研究(ウェットラボ)の間の伝統的な境界線を曖昧にしている。かつては、計算モデリングと物理的実験は、異なるチームによって行われる別個のフェーズであった。しかし、AI駆動の創薬においては、FRONTEO社(ドライラボAI)とAxcelead社(ウェットラボでの検証)が提携し、AIによる仮説生成と生物学的試験を効率的に循環させるエコシステムを構築している 3。自律実験室は、AI(脳)とロボティクス(手)を単一の自律的存在に統合することで、この融合を究極の形で体現している 27。MITのCREStやトロント大学のChemOSは、この融合を物理的に実現したものである 1。この統合は、シミュレーションと現実の間のフィードバックループがほぼ瞬時に行われる、新しい研究スタイルを生み出している。その結果、「計算科学者」と「実験科学者」という区別は意味を失いつつあり、未来の研究者は両方の領域に精通するか、あるいは緊密に統合されたチームで働くことが求められるだろう。
3.2 材料科学・化学:原子レベルからの未来設計
- 新材料発見:AIは、まだ合成されたことのない物質の特性を予測する能力を持つ。
- Google DeepMindのGNoMEは、深層学習を用いて220万の結晶構造から38万を超える潜在的に安定な新材料を予測した 1。これは既知の化学空間を大幅に拡張し、次世代バッテリーや超伝導体の探索を加速させるものである。
- イスラエルのMaterials Zone社は、データ駆動型の材料発見を促進するAIプラットフォームを提供している 2。
- 半導体製造:TSMCのような企業は、AIを用いて材料選定を最適化し、チップの性能、エネルギー効率、放熱性を向上させている 2。
- 自律的合成:前章で述べたように、自律実験室はAIが予測したこれらの新材料の合成と試験を自動化し、発見のループを閉じている 1。
3.3 環境・気候科学:複雑な世界のモデリング
- 気候・気象予測:GraphCastやNvidiaのFourCastNetといったAIモデルは、現在、精度と速度の両面で従来の予測システムを凌駕しており、10日間の全球予報を1分未満で提供できる 1。
- 災害レジリエンス:AIはリアルタイムのリスク評価に活用されている。富士通のAIはスーパーコンピュータ「富岳」上で津波の浸水を数秒で予測し、**NOAA(アメリカ海洋大気庁)**のような機関はより広範な環境モニタリングにAIを利用している 1。
- 持続可能性:生成AIは、環境に配慮した材料の設計や、気候変動緩和のための新たな戦略立案を支援している 2。
3.4 社会科学・人文科学:人間の経験への新たなレンズ
- 計算社会科学:大規模言語モデル(LLM)が、調査や実験における人間の被験者をシミュレートするために利用され始めている 34。これは人間のデータに完全に取って代わるものではないが、研究者が仮説を低コストで検証し、パイロットスタディを実施し、研究デザインを洗練させることを可能にする。研究によれば、LLMの予測は、測定された人間の反応と高い相関(相関係数0.85)を示すことがあるが、回答分布の一致性やバイアスの問題といった課題も残されている 34。
- 経済学:生成AIは、消費者や企業といった経済主体をシミュレートする**エージェントベース・モデリング(ABM)**に応用されている 35。これらのAIエージェントが、実質賃金に応じて支出を調整したり、市場構造に応じて価格設定行動を変えたりするなど、経済学の理論と整合的な振る舞いを再現できることが示されている 35。
- 歴史学・デジタル人文学:AIは、米国議会図書館が所蔵する数百万ページに及ぶ新聞や、フィンランド公文書館の裁判記録といった、膨大なデジタルアーカイブの解析に利用されている 36。これにより、言語の経時的変化の追跡 37 や、歴史的物語におけるパターンの特定 38 が可能になる。この分野では、こうした確率論的な新しい手法が、伝統的な解釈学的アプローチにどのような挑戦を突きつけるかが議論されている 39。
第4章 共生する科学者:人間の研究者の役割の再定義
生成AIの普及は、研究者のアイデンティティ、スキル、さらには認知プロセスにまで深い影響を及ぼしている。本章では、AI時代における研究者の役割がどのように変化し、どのような新しいスキルセットが求められるのか、そして人間とAIの協業がもたらす認知的影響について考察する。
表2:AI時代に求められる研究者のスキルセットの進化
| 従来のスキル | AIによる変革 | 新たなコアコンピテンシー | 根拠・事例 | 典拠 |
| データ収集・実験遂行 | AIが退屈な実験作業やデータ収集を自動化 | 戦略的監督と目標設定 | 人間は高次の研究課題を設定し、自律システムの「ミッション」を設計する | 27 |
| 情報の記憶・想起 | AIが膨大な情報への即時アクセスを提供 | 批判的思考と情報源の評価 | 人間は「流暢だが間違っている」可能性のあるAIの出力を厳密に問い、検証し、文脈化する必要がある | 1 |
| 技術的習熟(コーディング/統計) | AIが自然言語からコード生成や分析を実行 | AIフルエンシーとプロンプトエンジニアリング | 望ましい結果を得るために、AIシステムと効果的に対話し、誘導するスキルが不可欠となる | 42 |
| 専門分野の深化 | 単一分野における深い知識 | 学際的統合能力 | AIが分野間の橋渡し役となり、人間には異分野の洞察を結びつけ、複雑な問題を構成する能力が求められる | 44 |
| 分析的推論 | 既知のモデルをデータに適用 | 創造的な問題設定とアブダクション的思考 | AIには模倣できない、新たな問題の発見、新しい目標の設定、創造的なひらめきを提供する | 24 |
4.1 進化するスキルセット:実行から問いかけへ
研究者に求められるスキルの重心は、手作業の「実行」から、より創造的で戦略的な役割へと移行している 47。批判的思考、複雑な問題解決能力、創造性、そして感情的知性といった、人間特有のスキルがますます重要になっている 42。
AIフルエンシーは、新たな基礎スキルとして位置づけられる。これは、AIツールを生産的かつ安全に活用するための実践的な能力であり、単にツールを使うだけでなく、その限界を理解し、自身のワークフローに「プロンプトを出し、評価し、統合する」能力を含む 42。
特に、AIの出力を批判的に評価する能力は不可欠である。AIは「ハルシネーション」として知られる、もっともらしい虚偽情報を生成することがあるため、研究者はAIが提示した情報の出所を問い、バイアスの有無を検証し、事実確認を徹底するよう訓練されなければならない 41。
4.2 人間とAIの協業モデル:アシスタントから対等なパートナーへ
人間とAIの関係は、AIを単なる「アシスタント」と見なす段階を超えつつある 49。先進的な応用事例では、AIはむしろ対等な「協力者」として機能し、人間が評価し追求すべき斬新なアイデアや研究経路を提案する 5。
この文脈において、科学者の役割は、強力なAIツールを導き、その出力を解釈し、それらを一貫した科学的物語へと紡ぎ上げる「指揮者」や「羊飼い」のようなものになる 5。科学者は、AIが持ち得ない重要な専門知識と倫理的判断力を提供する 40。
この新しい協業モデルは、研究の生産性に一様ではない影響を与える可能性がある。生成AIは、すべての研究者の生産性を等しく向上させる万能薬ではない。むしろ、既存の能力を増幅させる「能力増幅器」として機能し、生産性の二極化を引き起こす可能性がある。ある企業研究者を対象とした実験では、上位10%の研究者の生産性が81%向上した一方で、下位3分の1の研究者にはほとんど効果が見られなかったという結果が報告されている 51。一方で、タクシードライバーを対象とした別の研究では、AIナビゲーションツールがスキルレベルの低いドライバーの生産性を最も向上させたことが示された 52。これらの結果は一見矛盾しているように見えるが、タスクの性質を考慮することで統合的に理解できる。ナビゲーションのような定型的・手続き的なタスクにおいては、AIは初心者を支援し、スキル格差を埋めることができる。しかし、研究のような複雑で創造的なタスクにおいては、AIを効果的に活用するために必要な高度なスキル(批判的思考、問題設定能力など)をすでに備えている研究者の能力を飛躍的に高める。したがって、研究の未来は、一様な加速ではなく、AIを使いこなす「スーパープロデューサー」と、そうでない研究者との間の生産性ギャップが拡大する世界かもしれない。
4.3 認知的影響:「摩擦のない」研究のリスク
AIが約束する「摩擦のない(frictionless)」ユーザー体験は、効率化をもたらす一方で、認知的な負の側面を持つ可能性がある 53。記憶から事実を掘り起こしたり、複雑なテキストと格闘したりといった、従来の「摩擦」を伴う研究プロセスは、深い学習と専門知識の構築に不可欠な要素であった。
MITで行われた実験では、ChatGPTを用いてエッセイを執筆した被験者は、認知処理、注意力、創造性に関連する脳のネットワーク活動が著しく低下することが示された 53。これは、AIに認知負荷の高い作業を委ねることが、思考力の低下につながる可能性を示唆している。
若手研究者のジレンマ
この問題は、特にキャリアの浅い研究者にとって深刻である。基礎的なタスクをAIに過度に依存することは、経験と試行錯誤を通じて培われるべき判断力や批判的思考能力の発達を阻害する恐れがある 54。指導的立場にある研究者は、若手研究者がAIを「経験的学習」の機会を奪う松葉杖としてではなく、学習を補助する足場として利用するよう、積極的に指導する必要がある 54。
第5章 迷宮をナビゲートする:ガバナンス、インテグリティ、倫理的責務
生成AIは研究に革命をもたらす一方で、信頼性、透明性、学術的不正行為に関する深刻なリスクと課題を提起している。本章では、これらの課題を批判的に検討し、それらを緩和するために生まれつつあるガバナンスの枠組みを分析する。
表3:主要学術出版社のAIポリシー比較分析
| 出版社/ジャーナル群 | AIの著者資格に関するポリシー | AI生成画像・データに関するポリシー | AI利用の開示・謝辞要件 | 査読者向けポリシー | 典拠 |
| Springer Nature | AIを著者として認めない。著者は作品に責任を負う必要があり、LLMはそれを満たせないため。 | 原則としてAI生成画像の掲載を許可しない。例外あり(AIに関する論文など)。 | テキスト生成にLLMを利用した場合、方法(Methods)セクション等で明記する必要がある(軽微なコピー編集は除く)。 | 査読中の原稿を生成AIツールにアップロードしてはならない。 | 55 |
| Taylor & Francis | AIを著者として記載してはならない。著者資格には人間固有の責任が伴うため。 | 画像、図、研究データの作成・操作に生成AIを使用することを現在許可していない。 | AIツールを使用した場合は、ツールの名称、使用方法、理由を論文または書籍内で明確に記述する必要がある。 | 未発表の原稿を生成AIツールにアップロードしてはならない。レビューの言語改善支援には利用可能だが、内容の正確性には査読者が責任を負う。 | 58 |
5.1 「ブラックボックス」問題:信頼、透明性、再現可能性
多くのAIモデルが持つ「ブラックボックス」性、すなわちその推論過程が解釈困難であることは、科学の根幹をなす透明性と再現可能性を脅かす中心的な課題である 1。
- ハルシネーションと不正確さ:生成AIは、もっともらしいが事実に基づかない情報(ハルシネーション)を生成することが知られている 58。これを研究者が厳密に検証せずに学術論文に組み込んでしまえば、深刻な誤りが科学的知識体系に混入するリスクがある。
- アルゴリズム的バイアス:AIモデルは、その訓練データに内在するバイアスを学習し、増幅する傾向がある 1。偏った、あるいは質の低いデータで訓練されたAIは、不公平で誤解を招くような結果を生み出し、研究における社会的な偏見を永続させる可能性がある。
5.2 学術的不正行為の新たな側面
AIは、盗用や捏造といった伝統的な学術不正の定義を複雑化させている。
- AI支援による盗用:AIは文章を非常に巧みに言い換えることができるため、従来の盗用検知ツールを回避しつつ、他者のアイデアを盗用することが可能になる。これにより、著者が意図せず他者の概念を帰属表示なしに使用してしまう「不注意による盗用」のリスクが高まる 59。
- データと画像の操作:合成データやAI生成画像を容易に作成できることは、研究データの捏造リスクを増大させる 59。科学論文の画像不正を検出するProofigのようなツールも登場しているが、これは技術的な「いたちごっこ」の始まりに過ぎない 61。
- 検知技術の限界:AIが生成したテキストを確実に検出することは極めて困難である。OpenAI社自身も、その精度の低さから自社のAI検知ツールを閉鎖した 62。人間の査読者もAI生成テキストの識別能力が低いことが研究で示されており、ある研究ではAIが生成した抄録の32%を人間が書いたものと誤認した 59。
これらの事実は、学術的インテグリティを確保するためのアプローチが根本的な転換を迫られていることを示唆している。AI検知ツールの信頼性が低い以上、完成した成果物を事後的に検査するという従来のパラダイムは時代遅れになりつつある。これからの研究ガバナンスは、成果物の事後検知から、研究プロセス全体のインテグリティを維持・検証することへと重点を移さざるを得ない。この新しいパラダイムでは、研究の信頼性は、最終的な論文が人間のみによって書かれたという前提に基づくのではなく、研究者がAIとの対話を含む自身の研究ワークフローの透明で監査可能な記録を提示できるかどうかにかかってくる。例えば、日本の公正研究推進協会は、研究者がAIのプロンプトと応答のログを保存し、第三者が検証できるようにすることを推奨している 59。また、MITスローン経営大学院では、学生にAIの使用方法を詳述する「プロセス・ステートメント」の提出を求めることを提案している 62。これにより、立証責任は、不正を「検知する」機関側から、プロセスの正当性を「証明する」研究者側へと移行していくことになる。
5.3 制度的対応:ガバナンス・フレームワークの構築
この新たな課題に対応するため、学術界の各主体がガバナンスの枠組みを構築し始めている。
- 出版社のポリシー:前掲の表3に示したように、主要な学術出版社は明確なガイドラインを策定している。その核心にあるコンセンサスは、最終的な責任は常に人間が負うべきという点である。AIは、その成果物に責任を負うことができないため、著者として認められない 55。また、AIツールの使用については、完全な透明性が求められる 57。
- 大学のガイドライン:各大学も独自のガイドラインを策定しており、学生や研究者が自身の思考をAIに「アウトソース」しないことの重要性を強調している 41。これらのガイドラインは、AIの出力結果を鵜呑みにせず検証すること、機密情報や個人情報をパブリックなモデルに入力しないこと、そして課題においては人間による貢献とAIによる支援を明確に区別することなどを求めている 41。
- 国際機関:欧州委員会のような国際機関も、研究におけるAIの責任ある利用に関するガイドラインを発表している。これには、査読のような機密性の高い活動におけるAIツールの使用に慎重であることや、知的財産権を尊重することなどが含まれる 63。
第6章 次なるフロンティア:学際的統合と知の創造の未来
本レポートの締めくくりとして、生成AIが個々の学問分野内の発見を加速させるだけでなく、前例のない学際的協力を促進することによって、知の構造そのものをどのように再構築していくのか、その未来像を展望する。
6.1 学際的研究の触媒としてのAI
気候変動や世界的な健康危機といった複雑な地球規模の課題は、単一の学問分野の枠組みを超える解決策を必要としている 46。生成AIは、このニーズに応える独自の能力を備えている。
大規模言語モデル(LLM)は、その訓練データが数え切れないほどの分野にまたがっているため、本質的に学際的である。研究者が入力するプロンプトに対する応答は、自然な形で研究者を自身の専門領域外の概念や関連性へと導く可能性がある 46。
これにより、学際的研究への参入障壁が低下する。複数のLLMを用いて反復的にプロンプトを生成するMulti-LLM Iterative Prompting Methodology (MIPM)や、「LLMエキスパート」間の対話をシミュレートするSTORMのようなツールは、多様な専門分野の視点を統合するための構造化されたフレームワークを提供する 46。スタンフォード大学のHAI(人間中心のAI研究所)のような機関は、従来の学部の壁を越えるこのような学際的AI研究を促進するために設立されている 44。
6.2 技術の収斂:AI、ロボティクス、量子コンピューティング
AIがもたらす未来のインパクトは、他の変革的技術との収斂(コンバージェンス)によって増幅されるだろう。
- AIとロボティクス:自律実験室の事例で見たように、AIの「脳」とロボットの「身体」の融合は、発見のサイクル全体を自動化している 25。現実世界と相互作用する「物理的AI(Physical AI)」の台頭は、将来的に不可欠なスキルとなるだろう 45。
- AIと量子コンピューティング:AIのパターン認識能力と、量子コンピュータが持つシミュレーションおよび最適化の能力を組み合わせることで、創薬や材料科学といった分野で現在では解決不可能と考えられている問題に対する解決策が拓かれる可能性がある 64。
6.3 総括:責任ある革新的な研究エコシステムの育成
本レポートで論じてきたように、生成AIは、人間中心の発見から人間と機械の共生モデルへと移行する、研究における根本的なパラダイムシフトを意味する。
この変革は二面性を持つ。一方では、新材料発見の44%増加や特許申請の39%増加といった、前例のない研究開発の加速と機会をもたらす 51。他方で、研究のインテグリティ、倫理、そして研究者育成に対する深刻な課題を突きつけている 1。
最終的な行動喚起は、大学、資金提供機関、出版社、そして個々の研究者を含む研究コミュニティ全体に向けられる。それは、単に新しいツールを導入するだけでなく、AIが人間の知の探求を損なうのではなく、向上させることを確実にするために、研究方法論、教育カリキュラム、ガバナンスモデルを根本的に再考することである 65。目指すべき未来は、AIと人間の知性が協働し、人類が直面する最も困難な課題を解決する世界である。
Works cited
- AI for science: India’s chance to leapfrog the R&D race – The Times …, accessed October 23, 2025, https://timesofindia.indiatimes.com/technology/times-techies/ai-for-science-indias-chance-to-leapfrog-the-rd-race/articleshow/124731960.cms
- Gen AI in Scientific Research: Transforming Discoveries – Xite.AI, accessed October 23, 2025, https://xite.ai/blogs/generative-ai-in-scientific-research-accelerating-discoveries-and-innovations/
- 創薬研究における 仮説生成AIの活用とターゲットバリデーション | 特別会員開催イベント | LINK-J, accessed October 23, 2025, https://www.link-j.org/member_event/post-7575.html
- “仮説生成AI” が創薬研究を推進する- FRONTEO Drug Discovery AI …, accessed October 23, 2025, https://lifescience.fronteo.com/ddaif/hypothesis-generative-ai
- AIが勝手に大発見!? 科学研究の常識を覆す最新技術「AUTODS」を徹底解説! – note, accessed October 23, 2025, https://note.com/rami_engineer/n/n7f0053edc7d0
- 【2025年版】研究者にお勧めのAIツール6選 – Trinka AI, accessed October 23, 2025, https://www.trinka.ai/jp/blog/six-best-ai-tools-every-scholars-should-try/
- 文献調査に利用できる生成AIツールと、その使われ方, accessed October 23, 2025, https://reposit.sun.ac.jp/dspace/bitstream/10561/1967/4/v57n2p19_moriuchi.pdf
- 【トレンド】解説!AIを用いた論文検索ツールの現状と注意点(2025年8月更新) – デジぽち, accessed October 23, 2025, https://guide.m3dc.co.jp/trend_ai-search-engine-for-thesis
- 研究でのAI活用術〜第1回:文献調査の新常識:生成AIで知識獲得を最大化する – note, accessed October 23, 2025, https://note.com/juicy_heron1450/n/na0886fc211da
- AI in Academic Writing – Clemson University, accessed October 23, 2025, https://www.clemson.edu/centers-institutes/writing/writing-resources/writing-resources/ai-in-academic-writing.html
- Ethical use of AI in writing assignments | Center for Teaching Excellence, accessed October 23, 2025, https://cte.ku.edu/ethical-use-ai-writing-assignments
- AI Experimental Design Optimizer GPT Agent | Taskade, accessed October 23, 2025, https://www.taskade.com/agents/research/experimental-design-optimizer
- Experimental Design in the AI Era | Eni digiTALKS – Medium, accessed October 23, 2025, https://medium.com/eni-digitalks/experimental-design-in-the-ai-era-98f7cb095635
- How does Design of Experiments work with AI? » Lamarr-Blog, accessed October 23, 2025, https://lamarr-institute.org/blog/design-of-experiments/
- materials-data-facility/awesome-bayesian-optimization – GitHub, accessed October 23, 2025, https://github.com/materials-data-facility/awesome-bayesian-optimization
- データ分析におすすめの生成AI3選!生成AIの活用例も紹介 – 侍エンジニア, accessed October 23, 2025, https://generative-ai.sejuku.net/blog/4734/
- 生成AIでデータ分析を加速!おすすめ生成AIツールと事例集 – WEEL, accessed October 23, 2025, https://weel.co.jp/media/innovator/gen-ai-data-analysis/
- 【2025年】最新AIを活用したデータ分析ツールおすすめ比較11選!選び方も解説, accessed October 23, 2025, https://aicentralapp.com/media/ai-analysis-comparison/
- 【簡単】生成AIでデータ分析を行う方法|おすすめツール3選も紹介 – メタバース総研, accessed October 23, 2025, https://metaversesouken.com/ai/generative_ai/data-analysis-3/
- AIデータ分析ツールおすすめ17選|無料で使えるツールや選び方、ChatGPT連携も紹介!, accessed October 23, 2025, https://ai-keiei.shift-ai.co.jp/ai-data-analysis-tools/
- A complete guide to using AI for academic writing, accessed October 23, 2025, https://effortlessacademic.com/a-complete-guide-to-using-ai-for-academic-writing/
- Paperpal: AI Academic Writing Tool – Comprehensive AI Research Assistant, accessed October 23, 2025, https://paperpal.com/
- AIによる科学の加速: 各領域での革新と共創の未来 – note, accessed October 23, 2025, https://note.com/masayamori/n/n4b4f4ac3d7d9
- 生成AI時代に差がつくアブダクション思考とは?活用例とメリットを解説, accessed October 23, 2025, https://smeai.org/index/abduction-thinking-in-ai-era/
- AI for Discovery and Self-Driving Labs, accessed October 23, 2025, https://www.matter.toronto.edu/basic-content-page/ai-for-discovery-and-self-driving-labs
- 欲しい物質を自動的・自律的に合成する | Science Tokyo – 東京科学大学, accessed October 23, 2025, https://www.isct.ac.jp/ja/news/x3l5aw2oe9q1
- AI-Powered “Self-Driving” Labs: Accelerating Life Science R&D | Tips and Tricks – Scispot, accessed October 23, 2025, https://www.scispot.com/blog/ai-powered-self-driving-labs-accelerating-life-science-r-d
- Accelerating research with AI-assisted experiments, accessed October 23, 2025, https://dmse.mit.edu/news/accelerating-research-with-ai-assisted-experiments/
- Tuning of Bayesian optimization for materials synthesis: simulation of the one-dimensional case, accessed October 23, 2025, https://www.tandfonline.com/doi/full/10.1080/27660400.2022.2066489
- 欲しい物質を自動的・自律的に合成する – 科学技術振興機構(JST), accessed October 23, 2025, https://www.jst.go.jp/pr/announce/20250514-2/index.html
- PRESS RELEASE 欲しい物質を自動的・自律的に合成する – 国立研究開発法人 科学技術振興機構, accessed October 23, 2025, https://www.jst.go.jp/pr/announce/20250514-2/pdf/20250514-2.pdf
- Generative AI in Life Sciences: Use Cases & Examples, accessed October 23, 2025, https://research.aimultiple.com/generative-ai-in-life-sciences/
- What is Generative AI? | IBM, accessed October 23, 2025, https://www.ibm.com/think/topics/generative-ai
- Social science researchers use AI to simulate human subjects …, accessed October 23, 2025, https://news.stanford.edu/stories/2025/07/ai-social-science-research-simulated-human-subjects
- (リサーチラボ)生成AIの経済シミュレーションにおける応用可能性 …, accessed October 23, 2025, https://www.boj.or.jp/research/wps_rev/lab/lab25j01.htm
- 歴史学の未来 AIは膨大な史料から 何を見出せるか? – MITテクノロジーレビュー, accessed October 23, 2025, https://www.technologyreview.jp/s/306063/how-ai-is-helping-historians-better-understand-our-past/
- Computational Social Science: Research & Networking Series, accessed October 23, 2025, https://datascience.columbia.edu/research/centers-and-working-groups/computational-social-science-research-networking-series/
- 【雑記】生成AIは史料を読むことができるか|豊嶋順揮 – note, accessed October 23, 2025, https://note.com/shunhui0519/n/n4d5221a68e75
- Digital Humanities and Generative AI: yet another methodological turn? – Zenodo, accessed October 23, 2025, https://zenodo.org/records/14957075
- The fifth era of science: Artificial scientific intelligence – PMC, accessed October 23, 2025, https://pmc.ncbi.nlm.nih.gov/articles/PMC12176288/
- 教育における生成AI活用のガイドライン2024(学生向け) – 筑波大学, accessed October 23, 2025, https://www.tsukuba.ac.jp/about/action-management/pdf/AI-20241114134800-1.pdf
- 7 skills Harvard says will keep you employed in the age of ChatGPT, accessed October 23, 2025, https://timesofindia.indiatimes.com/education/news/7-skills-harvard-says-will-keep-you-employed-in-the-age-of-chatgpt/articleshow/124550008.cms
- How AI is transforming academic research – University of Miami News, accessed October 23, 2025, https://news.miami.edu/stories/2025/10/how-artificial-intelligence-is-transforming-academic-research.html
- Stanford HAI: Home, accessed October 23, 2025, https://hai.stanford.edu/
- Educating a future workforce that will match AI disruption – The World Economic Forum, accessed October 23, 2025, https://www.weforum.org/stories/2025/10/education-disruptive-ai-workforce-opportunities/
- The Rise of Multidisciplinary Research Stimulated by AI Research …, accessed October 23, 2025, https://upcea.edu/the-rise-of-multidisciplinary-research-stimulated-by-ai-research-tools/
- 生成 AI 時代の DX 推進に必要な人材・スキルの考え方 (令和 5 年 8 月), accessed October 23, 2025, https://www.meti.go.jp/press/2023/08/20230807001/20230807001-b-1.pdf
- 生成AIの活用に関するガイドライン – 明治大学, accessed October 23, 2025, https://www.meiji.ac.jp/keiei/6t5h7p00000ivup3-att/seiseiai.pdf
- Science in the age of AI – Royal Society, accessed October 23, 2025, https://royalsociety.org/-/media/policy/projects/science-in-the-age-of-ai/science-in-the-age-of-ai-report.pdf
- AI Research Scientist Career Guide — Salary & Requirements – University of San Diego Online Degrees, accessed October 23, 2025, https://onlinedegrees.sandiego.edu/ai-research-scientist-career/
- 生成AIが企業研究者の生産性に与える影響を検証——「上位10%の研究者は生産性が81%向上、下位3分の1の研究者にはほとんど効果なし」の結果に | Ledge.ai, accessed October 23, 2025, https://ledge.ai/articles/ai_scientific_discovery_innovation
- 生成AIが生産性を底上げする – 雇用・スキルに与える影響とは。経済学者に聞く – アデコ, accessed October 23, 2025, https://www.adeccogroup.jp/power-of-work/306
- Are we living in a golden age of stupidity?, accessed October 23, 2025, https://www.theguardian.com/technology/2025/oct/18/are-we-living-in-a-golden-age-of-stupidity-technology
- Time to grow: How is AI impacting the future research workforce? | Feature, accessed October 23, 2025, https://www.research-live.com/article/features/how-is-ai-impacting-the-future-workforce/id/5143893
- Manuscript Guidelines | Publish your research – Springer Nature, accessed October 23, 2025, https://www.springernature.com/gp/authors/publish-a-book/manuscript-guidelines
- Editorial policies | Policies | Springer Nature, accessed October 23, 2025, https://www.springernature.com/gp/policies/editorial-policies
- How can I use generative AI tools to support me with writing my paper? – Nature Research Assistant, accessed October 23, 2025, https://natureresearchassistant.com/resources/using-generative-ai-tools-for-paper-writing
- AI Policy – Taylor & Francis, accessed October 23, 2025, https://taylorandfrancis.com/our-policies/ai-policy/
- 生成AI活用論文の品質評価と査読基準における課題と懸念点, accessed October 23, 2025, https://education.smeai.org/ai-academic-paper-review-challenges-concerns/
- 生成AIのセキュリティリスクと研究動向 – 情報処理学会, accessed October 23, 2025, https://www.ipsj.or.jp/dp/contents/publication/61/DP61-S02.html
- Proofig AI | Upholding Research Integrity with AI Image Detector & Plagiarism Checker, accessed October 23, 2025, https://www.proofig.com/
- AI Detectors Don’t Work. Here’s What to Do Instead., accessed October 23, 2025, https://mitsloanedtech.mit.edu/ai/teach/ai-detectors-dont-work/
- 欧州委員会、研究活動における生成AIの責任ある使用に関するガイドラインを策定, accessed October 23, 2025, https://current.ndl.go.jp/car/212304
- 生成AIが研究開発の未来を変える|株式会社AIworker – note, accessed October 23, 2025, https://note.com/ai__worker/n/n010eda3e02fd
- AI and the Future of Universities – HEPI – Higher Education Policy Institute, accessed October 23, 2025, https://www.hepi.ac.uk/reports/right-here-right-now-new-report-on-how-ai-is-transforming-higher-education/
睡眠時無呼吸症候群の舌下神経刺激療法とは
睡眠時無呼吸症候群(SAS)における「舌下神経刺激療法(Hypoglossal Nerve Stimulation: HNS)」は、体内に小型の医療機器を植え込み、睡眠中に舌を動かす神経(舌下神経)を電気的に刺激することで、気道の閉塞を防ぐ比較的新しい治療法です。
日本では「インスパイア(Inspire)」と呼ばれるデバイスシステムが2021年6月から保険適用となっています。
1. 治療のメカニズム
閉塞性睡眠時無呼吸(OSA)の主な原因の一つは、睡眠中に舌や喉の筋肉が弛緩し、舌の付け根(舌根)が喉の奥に落ち込むことで気道を塞いでしまうことです。
舌下神経刺激療法は、このメカニズムに直接作用します。
- 呼吸の感知: 胸部に植え込まれたセンサーが、患者の呼吸のリズム(息を吸うタイミング)を感知します。
- 神経刺激: 呼吸に同期して、鎖骨下または胸部に植え込まれた本体(パルスジェネレータ)から、あごの下に留置された電極(刺激リード)へ微弱な電気が送られます。
- 気道の確保: 電気が舌下神経を刺激すると、舌の筋肉(特にオトガイ舌筋)が収縮し、舌が自動的に前方に引き出されます。
- 閉塞の防止: 舌が前方に移動することで、喉の奥のスペース(上気道)が広がり、空気が通りやすくなり、無呼吸やいびきを防ぎます。
患者さんは、就寝前に専用のリモコン(患者用プログラマ)を使って自分でデバイスのスイッチを入れ、起床時にオフにします。
2. 治療の対象となる患者
この治療は、睡眠時無呼吸症候群の標準治療であるCPAP(シーパップ:経鼻的持続陽圧呼吸療法)が、マスクの不快感や圧迫感などで継続できない(不忍容)、または効果が不十分な患者が主な対象です。
保険適用となるには、以下のようないくつかの条件を満たす必要があります。
- 18歳以上であること
- 中等症から重症の閉塞性睡眠時無呼吸症候群であること(無呼吸低呼吸指数(AHI)が原則20以上)
- CPAP療法が継続困難であること
- 肥満度が一定以下であること(BMI 30未満が目安)
- 扁桃肥大など、明らかな解剖学的な気道閉塞の原因がないこと
- 特定の検査(薬物睡眠下内視鏡検査など)で、この治療法が有効なタイプであると診断されること
3. 治療の実際(手術と管理)
- 手術: 治療には全身麻酔下での外科手術が必要です。主に、(1)鎖骨下の胸部(本体を設置)、(2)肋骨の間(呼吸センサーを設置)、(3)あごの下(舌下神経にリードを設置)の3ヶ所(または2ヶ所)を小さく切開し、デバイスシステムを皮下に植え込みます。
- 術後: 手術後、約1ヶ月ほど治癒期間を置いた後、デバイスを作動させ、患者さんに最適な刺激の強さを調整します。
- 管理: 治療開始後も定期的に通院し、デバイスの作動状況の確認や設定の調整を行います。
4. メリットとデメリット
メリット:
- CPAPのようなマスクやチューブを装着する必要がなく、睡眠中の不快感から解放されます。
- 装置が体内に植え込まれるため、旅行などでの持ち運びが不要です(リモコンは携帯します)。
- 呼吸に同期して生理的に近い形で気道を開存させます。
デメリット:
- 外科手術が必要であり、体内に機器を植え込む必要があります。
- すべての患者に有効とは限らず、適応基準が厳密に定められています。
- 治療を実施できるのは、専門的な研修を受けた医師がいる認定施設に限られます。
- 数年ごとにデバイスの電池交換(本体の交換手術)が必要になる場合があります。
(Gemini)
【CPAPが合わない?】睡眠時無呼吸の新しい治療法|舌下神経電気刺激療法を睡眠専門医が解説 岐阜で働く睡眠障害の専門医 チャンネル登録者数 1540人
以下、Perplexityによる解説
Hypoglossal Nerve Stimulation: HNS for SAS [
Hypoglossal Nerve Stimulation (HNS) is a relatively new and FDA-approved treatment option for patients with moderate to severe Obstructive Sleep Apnea Syndrome (SAS or OSA) who are intolerant or do not benefit sufficiently from positive airway pressure (PAP) therapy. HNS works by electrically stimulating the hypoglossal nerve, which controls tongue movement, causing tongue protrusion and dilation of the upper airway to prevent airway collapse during sleep.
Key points about HNS for SAS/OSA include:
- HNS is typically considered a second-line therapy for patients who cannot adhere to or do not respond well to CPAP treatment.
- Patient selection criteria generally include an apnea-hypopnea index (AHI) between about 15 and 65 events per hour, body mass index (BMI) below 35 kg/m², absence of complete concentric collapse of the velum detected by sleep endoscopy, and exclusion of predominantly central sleep apnea.
- Studies show HNS leads to significant improvement in sleep apnea severity, patient-reported outcomes such as sleepiness, insomnia, depression, and quality of life, comparable to or better than PAP in some cases.
- HNS therapy has higher patient compliance rates than CPAP, with around 86% adherence compared to 40-60% for CPAP after one year.
- The typical HNS system includes a cuff electrode around a branch of the hypoglossal nerve, a sensor detecting breathing effort, and an implantable pulse generator implanted in the chest.
- HNS implantation requires careful preoperative assessment, including sleep endoscopy for airway anatomy, and is followed by interdisciplinary aftercare.
- Adverse events are generally low and minor, with proper patient selection and expert surgical technique minimizing complications.
In summary, hypoglossal nerve stimulation is a safe, effective, and well-tolerated therapeutic option for selected patients with moderate to severe obstructive sleep apnea who are unable to adhere to conventional PAP therapy. It improves objective sleep apnea metrics and patient quality of life, representing an important advancement in SAS treatment options.[1][2][3][4][5][6]
- https://pmc.ncbi.nlm.nih.gov/articles/PMC8587218/
- https://pmc.ncbi.nlm.nih.gov/articles/PMC8738404/
- https://www.longdom.org/open-access/therapy-for-obstructive-sleep-apnea-using-hypoglossal-nerve-stimulation-104595.html
- https://www.entnet.org/resource/position-statement-hypoglossal-nerve-stimulation-for-treatment-of-obstructive-sleep-apnea-osa/
- https://resm.info/【睡眠時無呼吸症候群について①】睡眠時無呼吸/
- https://www.sciencedirect.com/science/article/pii/S0954611124003019
- https://www.jstage.jst.go.jp/article/jsrcr/32/2/32_111/_html/-char/ja
- https://aao-hnsfjournals.onlinelibrary.wiley.com/doi/full/10.1002/ohn.883
- https://www.hatano-cl.com/wp-content/uploads/220111.pdf
- https://www.atsjournals.org/doi/abs/10.1164/ajrccm.2025.211.Abstracts.A2897
(Perplexity)
組織内の代謝物の局在を調べる方法:組織切片+質量分析
質量分析は試料中の物質を同定する方法ですが、生体の組織や細胞のどこにその物質があるかということに関しては、高分解能の情報は得られないものと思っていました。しかし切片から直接部分的にビームを当てて、イオン化して試料分析に逐次かけていくという技術が開発されていたようです。
Mass Spectrometry for Metabolomics Chemical & Engineering News チャンネル登録者数 2.72万人
Gooogle AIによる概要
In beam mass spectrometry for biological tissue section localization, a focused beam of energy or particles is directed at a tissue sample to desorb and ionize molecules. A mass spectrometer then analyzes these ions, with the location of each analysis point recorded to reconstruct a “molecular map” showing the spatial distribution of hundreds of different compounds in the tissue. This technique is broadly known as mass spectrometry imaging (MSI).
Key beam-based MSI techniques for tissue analysis include:
Laser-based techniques
Matrix-assisted laser desorption/ionization (MALDI) MSI
- Method: A thin tissue section is first coated with a crystalline matrix compound. A pulsed laser beam is then rastered across the surface, with the matrix absorbing the laser energy, which co-desorbs and ionizes the tissue’s molecules.
- Resolution: Spatial resolution is determined by the size of the laser spot, typically 10 to 100 micrometers. Recent advancements using laser beam scanning have achieved resolutions as fine as 10 μm.
- Applications: Used to map the distribution of a wide range of biomolecules, including lipids, peptides, and proteins. MALDI is often combined with high-resolution mass analyzers, such as Fourier transform ion cyclotron resonance (FT-ICR) MS, for exceptional mass accuracy.
Laser ablation inductively coupled plasma mass spectrometry (LA-ICP-MS)
- Method: A laser beam ablates—or vaporizes—a minute amount of tissue, which is then transported to an inductively coupled plasma (ICP). The plasma’s high temperature atomizes and ionizes the material, and a mass spectrometer quantifies the elemental isotopes present.
- Resolution: Capable of producing high-resolution elemental maps, down to the micrometer or sub-micrometer level.
- Applications: Used for imaging metals, metalloids, and other trace elements within tissues. It is particularly valuable for toxicology, and for studying metal-related diseases like neurodegenerative disorders.
Ion beam-based techniques
Secondary ion mass spectrometry (SIMS)
- Method: A focused beam of high-energy ions (the primary beam) bombards the tissue surface, causing secondary ions to be ejected. These secondary ions are collected and analyzed by a mass spectrometer.
- Resolution: Known for its exceptional spatial resolution, with specialized NanoSIMS instruments achieving sub-100 nm resolution.
- Applications: Used for high-resolution imaging of small molecules, such as lipids and metabolites, and for determining isotopic ratios. Its high vacuum requirement and surface sensitivity make it well-suited for single-cell analysis.
Ambient ionization beam techniques
Desorption electrospray ionization (DESI)
- Method: A charged spray of solvent microdroplets is directed at the tissue at ambient pressure. As the droplets hit the surface, they extract and ionize molecules, which are then analyzed by a mass spectrometer.
- Resolution: Generally provides lower spatial resolution (typically 50–200 μm) compared to high-vacuum methods, but offers the advantage of minimal sample preparation.
- Applications: Useful for rapid, real-time molecular profiling during surgical procedures (mass spectrometry-guided surgery) and for mapping drugs and metabolites.
Nanospray desorption electrospray ionization (nano-DESI)
- Method: Uses a liquid microjunction formed by two capillaries to continuously extract and analyze analytes from the tissue surface.
- Resolution: An ambient technique that achieves high spatial resolution, with some reports demonstrating resolutions better than 10 μm.
- Applications: Offers a high-sensitivity method for imaging proteoforms and other biomolecules, with the ability to perform high-resolution protein mapping.
Workflow and applications
The general workflow for beam mass spectrometry on tissue sections involves several steps:
- Sample preparation: Freezing fresh tissue in liquid nitrogen followed by cutting thin sections (typically 10–20 μm) with a cryostat.
- Beam scanning: The tissue is placed on a conductive plate or slide and a beam is rastered across its surface.
- Spectral acquisition: A mass spectrum is generated for each pixel (location) analyzed by the beam.
- Data processing: Software converts the raw spectral data into visual, color-coded molecular maps showing the spatial distribution of specific molecules.
- Data integration: The resulting molecular images can be overlaid with traditional stained histology images to correlate molecular data with tissue pathology and microstructures.
These techniques are widely used in biomedical research to identify biomarkers, investigate disease pathology (e.g., tumor margins), and study the biodistribution of drugs and metabolites.
メッケル憩室とは?卵黄嚢茎の名残
プロンプト:ヒトの胎児の発生で、卵黄嚢茎は、何になりますか?消失する?それとも、盲腸の近くにある虫垂になる??
Gemini :
ヒトの胎児の発生において、卵黄嚢茎(らんおうのうけい、別名:卵黄管または臍腸管)は、通常は消失します。
虫垂にはなりません。
卵黄嚢茎のゆくえ
卵黄嚢茎は、発生のごく初期に、胎児の中腸(将来の小腸など)と卵黄嚢(栄養が入った袋)をつないでいる管です。
胎児が成長し、胎盤からの栄養供給が確立すると、卵黄嚢とこの管は不要になります。そのため、卵黄嚢茎は通常、妊娠の早い段階(妊娠5〜9週ごろ)で自然に閉じて、完全に退縮し、消失します。
虫垂とは?
虫垂(ちゅうすい)は、卵黄嚢茎とは全く別のものです。
虫垂は、盲腸(もうちょう:大腸の始まりの部分)の先端から突き出すように発生する、指のような形をした小さな管状の組織です。発生する場所も役割も、卵黄嚢茎とは異なります。
もし消失しなかったら?
まれに、卵黄嚢茎が完全に消失せずに一部が残ってしまうことがあります。
この残ってしまったものを「メッケル憩室(けいしつ)」と呼びます。これは小腸(回腸)の壁にできる小さな袋状の突起で、最も頻度の高い消化管の先天異常です。
したがって、卵黄嚢茎は「消失する」のが正解であり、もし残ったとしても「メッケル憩室」になるもので、虫垂になることはありません。
プロンプト:メッケル憩室とは?
**メッケル憩室(けいしつ)とは、一言でいうと「小腸にできる、生まれつきの小さな袋状の突起」**のことです。
消化管の先天的な異常(生まれつきの形態異常)の中では最も頻度が高いもので、全人口の約2%程度の人にあるとされています。
前の質問にあった**「卵黄嚢茎」と深く関係しています**。
1. なぜできるのか?(原因)
- 胎児の発生のとても早い時期、お母さんのお腹の中にいる赤ちゃん(胎児)は、「卵黄嚢(らんおうのう)」という袋から栄養をもらっています。
- この卵黄嚢と胎児の腸(中腸)は、「卵黄嚢茎(らんおうのうけい)」(または卵黄管)という管でつながっています。
- 胎児が成長し、胎盤が完成すると卵黄嚢は不要になるため、この卵黄嚢茎は通常、妊娠5~9週ごろまでに自然に退縮して完全に消失します。
- しかし、この卵黄嚢茎がうまく消失せずに、一部が腸側に残ってしまったものが「メッケル憩室」です。
つまり、メッケル憩室は「卵黄嚢茎のなごり」であり、本来なくなるべきものが残った状態です。
2. どんな特徴があるのか?
- 場所: 小腸の終わりの方(回腸)にできます。
- 異所性組織(いしょせいそしき): メッケル憩室の最大の特徴は、その袋の中に、小腸とは関係のない別の組織が迷い込んでいることがある点です。
- 最も多いのは「胃の粘膜」で、次に「膵臓の組織」などが見られます。
3. 症状は?
- ほとんど(95%以上)の人は無症状です。
- メッケル憩室を持っていても、一生何も症状が出ず、本人も気づかないまま生涯を終えることがほとんどです。
- 症状が出る場合(全保有者のうち約4%):
- 多くは乳幼児期(特に2歳以下)に症状が出ます。
- 症状の主な原因は、憩室内に迷い込んだ「胃の粘膜」です。
主な症状(合併症)
- 出血・下血(血便):
- 憩室内の胃粘膜が胃酸を分泌します。
- 小腸の壁は胃酸に耐えられないため、憩室の周辺が潰瘍になり、そこから出血します。
- 痛みはなく、突然、レンガ色やイチゴゼリー状の血便が出ることが特徴です。
- 憩室炎:
- 憩室が炎症を起こします。
- 虫垂炎(盲腸)と似たような腹痛(おへその周りや右下腹部の痛み)や発熱が起こります。
- 腸閉塞(イレウス):
- 憩室が原因で腸がねじれたり(軸捻転)、腸が重なってしまったり(腸重積)、憩室から伸びたヒモ状の組織に腸が絡まったりして、腸が詰まる状態です。
- 激しい腹痛、嘔吐、便が出ないなどの症状が出ます。
4. 治療は?
- 無症状の場合:
- 他の検査(CTなど)や手術で偶然発見された場合は、基本的に治療はせず、そのまま経過観察となります。
- 症状がある場合(出血や憩室炎、腸閉塞など):
- 外科手術でメッケル憩室を切除します。
まとめ
- メッケル憩室は、胎児期に消失するはずの「卵黄嚢茎」が残ったもの。
- 虫垂とは全く別物。
- ほとんどの人は無症状。
- まれに、憩室内の異所性胃粘膜が原因で出血したり、炎症を起こしたりすることがある。
小腸の発生(カールソンの教科書)
カールソンの発生学の教科書から、小腸の発生の章に関して、Google NotebookLMに音声概要を作ってもらいました。
AIによる自動生成のため、内容の正確さは保証しません。
前腸 foregut、中腸 midgut、後腸 hind gutは将来何になるか?栄養する動脈は?
消化管の発生、その中でも特にダイナミックで、臨床(特に小児外科)に直結する超重要なイベントについてお話しします。
テーマは「消化管の形成と固定」、そして「生理的臍帯ヘルニア」です。
なぜこれが重要か。皆さんが将来、臨床の現場で「胆汁を吐いている赤ちゃん」に出会った時、真っ先に「腸回転異常症」や「中腸軸捻転」を疑わなければなりません。なぜそんなことが起きるのか? それは、今日お話しする「正常な発生プロセス」が、どこかでうまくいかなかった結果だからです。
- 第51回 子宮外への適応-消化管疾患- https://koukyou.or.jp/ba-ba/vol51/
正常を知らずして、異常は理解できません。しっかりついてきてください。
消化管の基本プラン:3つの領域と担当動脈
まず、すべての基本から。
受精後4週ごろ、胚がこう、筒状に折りたたまれると、お腹の中に1本の単純なチューブができます。これが「原始腸管」ですね。
Embryology, GI tract Angelo Sotto チャンネル登録者数 181人
この長いチューブは、栄養をもらっている動脈(腹部大動脈の枝)に基づいて、明確に3つのエリアに分けられます。これはもう、解剖学、そして国家試験の必須知識です。
- 前腸 (Foregut)
- 中腸 (Midgut)
- 後腸 (Hindgut)
そして、これらに血液を送る動脈。3兄弟がそれぞれを担当します。
- 前腸 を栄養するのは?→ そう、「腹腔動脈 (Celiac trunk)」 です。
- 中腸 を栄養するのは?→ 「上腸間膜動脈 (Superior mesenteric artery: SMA)」
- 後腸 を栄養するのは?→ 「下腸間膜動脈 (Inferior mesenteric artery: IMA)」
この「領域」と「担当動脈」の対応関係は、発生が終わった成体になっても、そのまま引き継がれます。これが理解の土台になります。
各領域の「持ち場」(将来何になる?)
では、それぞれの領域が、将来どの臓器になるのかを見ていきましょう。
(スライドに各領域の分化先リストを表示)
① 前腸 (Foregut)
前腸は、消化管の上部と、そこから派生する重要な「付属器」を作ります。
- 消化管本体:
- 食道
- 胃
- 十二指腸(※肝臓や膵臓の出口=大十二指腸乳頭よりも上の部分)
- 付属器(前腸から芽が出るように発生):
- 肝臓、胆嚢
- 膵臓
- (実は気管や肺も、前腸から分岐してできます)
これら全部、腹腔動脈の支配領域ですね。
② 中腸 (Midgut)
ここが今日一番の主役です。最もダイナミックに動くエリア。
- 十二指腸(大十二指腸乳頭よりも下の部分)
- 空腸
- 回腸(つまり小腸の大部分)
- 盲腸、虫垂
- 上行結腸
- 横行結腸(の、右側2/3)
すごい広い範囲を担当しますよね。全部、SMAが栄養します。
③ 後腸 (Hindgut)
後腸は残りの部分です。
- 横行結腸(の、左側1/3)
- 下行結腸
- S状結腸
- 直腸
- 肛門管の上部
これらは全部、IMAの支配領域です。
(スライドに横行結腸の支配動脈の図を表示)
ここで「おや?」と思いますよね。横行結腸が、中腸と後腸の2つの領域にまたがっている。
その通りなんです。横行結腸は、発生過程で中腸由来のパーツと後腸由来のパーツが「合体」してできた臓器です。だから成体でも、SMAとIMAの両方から栄養をもらっている(辺縁動脈で吻合している)わけです。まさに発生の名残ですね。
消化管の固定:「腸間膜」の話
さて、この原始腸管チューブ、お腹の中でブラブラ浮いているわけじゃありません。
ちゃんと「腸間膜(ちょうかんまく)」という膜で、体壁に固定されています。
(スライドに胚の断面図を表示)
発生初期、チューブは「背中側」と「お腹側」の両方から固定されています。
- 背側腸間膜 (Dorsal mesentery):背中側に固定する膜。
- 腹側腸間膜 (Ventral mesentery):お腹側に固定する膜。
ここでの超重要ポイントは、**「腹側腸間膜は、ほとんど消える」**ということです。
なぜ消えるのか?
第一に、このあと説明する「中腸の回転」のように、腸がダイナミックに動くのに、お腹側で固定されていたら邪魔ですよね。
第二に、発生初期は左右に分かれていた腹腔が、この膜が消えることで合体し、一つの大きな「腹膜腔」になるためです。
腹側腸間膜の「生き残り」
「ほとんど消える」と言いましたが、例外があります。
唯一残るのが、前腸の末端部、つまり胃と十二指腸上部の周りだけです。
(スライドに肝臓と小網の発生図を表示)
この「唯一残った腹側腸間膜」の中に、なんと肝臓が発生して、ドーンと割り込んできます。
その結果、この膜は肝臓を境にして2つの部分に分けられます。
- 肝臓とお腹の壁(前腹壁) をつなぐ部分→ これが成体での**「肝鎌状間膜 (Falciform ligament)」**です。
- 肝臓と胃・十二指腸をつなぐ部分→ これが**「小網 (Lesser omentum)」**(肝胃間膜と肝十二指腸間膜のこと)です。
皆さんが解剖実習で見た「小網」や「肝鎌状間膜」は、あの広大な腹腔の中で、唯一生き残った「腹側腸間膜のなごり」というわけです。非常にエレガントですよね。
生理的臍帯ヘルニアと中腸の回転
Embryological Development of Gastro-Intestinal Tract – ACLAND Rahel Rashid チャンネル登録者数 1.72万人
中腸の発生は、非常に劇的です。キーワードは**「生理的臍帯ヘルニア」**。
これは病気じゃありません。「生理的」とつくとおり、我々全員が胎児の時に経験する、正常な発生プロセスです。
いつ起きる?(タイミング)
- カーネギーステージ (CS):
- CS 14〜16 ごろ(受精後 約6週)に、腸管が腹腔の外へ飛び出し始めます。
- CS 17〜23 ごろ(受精後 8〜9週)に、ヘルニアが最大になります。
- 解消(還納):
- 受精後 10〜12週 ごろにかけて、飛び出していた腸管がお腹の中に戻ってきます。この「戻ること」を**還納(かんのう)**と言います。
なぜ起きる?(理由・メカニズム)
理由はシンプルで、**「腹腔のスペース不足」**です。
この時期、胎児のお腹の中は、ある臓器が不釣り合いなほどデカくなって、パンパンなんです。
(スライドに胎児の腹腔断面図を表示)
犯人は、肝臓です。
胎生期の造血(血液を作る)は、骨髄じゃなくて主に肝臓が担っています。だから、肝臓がものすごく巨大化している。
そこへもってきて、中腸(小腸)が栄養吸収面積を稼ぐために、ものすごい勢いで長く伸び始めます。
小さな腹腔は、「巨大な肝臓」と「急成長する腸」を同時に収容できません。
行き場を失った中腸ループは、一番抵抗の少ない場所、つまり「へその緒(臍帯)」の付け根(体外腔)へと、一時的に「避難」するわけです。これが生理的臍帯ヘルニアです。
意義と目的: 腸管の「回転」
ただ避難するだけじゃありません。
この腹腔外にいる期間を利用して、中腸は最終的な「正しい配置」になるための、非常に重要な**「回転」**を行います。
(スライドに中腸回転のシェーマを表示)
- 軸: 回転の軸になるのは、中腸を栄養する**「上腸間膜動脈 (SMA)」**です。
- 方向: 前から見て**「反時計回り」**
- 角度: 合計 270度
この回転は2段階で起こります。
- 第1回転(90度): 6週ごろ、お腹の外に飛び出す(ヘルニアになる)時に、90度回転します。
- 第2回転(180度): 10週ごろ、お腹の中に戻る(還納する)時に、さらに180度回転します。
回転のゴールは?
この複雑な270度の回転によって、初めて腸は成体と同じ、あの正しい配置に収まるんです。
- 十二指腸はSMAの後ろを通ってC字型に固定されます。
- 盲腸や上行結腸は、お腹の左上からぐるーっと回って、最終的に右下腹部の正しい位置に収まります。
- 小腸間膜の付け根(腸間膜根)が、左上から右下へ斜めに広く固定されます。
もし、うまくいかなかったら?(臨床的意義)
この精巧なプロセスが、どこかで失敗すると、重篤な先天異常(=外科疾患)になります。
ケース1:腸が戻らない → 「臍帯(さいたい)ヘルニア (Omphalocele)」
受精後12週を過ぎても中腸が腹腔内に還納せず、へその緒の付け根に飛び出したまま生まれてくる状態です。
これは「生理的」ではなく「病的」なヘルニアです。飛び出した腸管が、羊膜などの膜に覆われているのが特徴です。
ケース2:回転がうまくいかない → 「腸回転異常症 (Intestinal Malrotation)」
これが非常に怖い。
腸はお腹の中に戻ったんだけど、あの「270度の反時計回り回転」が不完全だったパターンです。
(スライドに腸回転異常症と中腸軸捻転の図を表示)
何がマズイかというと、正常な回転が起きないと、腸間膜根(小腸を固定する根元)が、左上から右下まで広く固定されず、点のように「短く」なってしまいます。
根元が短いとどうなるか?
そう、不安定なんです。腸全体がブラブラの状態になる。
ブラブラな腸は、何かの拍子に、その短い根元を軸にして**「ねじれ」やすい。
これが「中腸軸捻転(ちょうねんてん) (Volvulus)」**です。
ねじれると何が起きますか?
軸になっていた上腸間膜動脈 (SMA) が、一緒に絞扼(こうやく)されます。
SMAが締まったら? 中腸領域、つまり小腸ほぼ全部と大腸の右半分への血流が、全部ストップします。
これはもう時間との勝負です。数時間で、広範囲の腸が壊死してしまう。新生児外科における最緊急疾患の一つです。
だから、「胆汁性の嘔吐」をする新生児を見たら、この腸回転異常症からの軸捻転を真っ先に疑う、というのが臨床の鉄則になるわけです。
(スライド:まとめ)
はい、今日のまとめです。
- 消化管は「前腸・中腸・後腸」に分かれ、それぞれ「腹腔・SMA・IMA」が担当する。
- 腹側腸間膜はほとんど消えるが、「小網」と「肝鎌状間膜」として残る。
- 中腸は6週~10週にかけて、スペース不足(巨大な肝臓)で「生理的臍帯ヘルニア」を起こす。
- この時、SMAを軸に「270度反時計回り」に回転し、正しい位置に収まる。
- このプロセスが失敗すると、「臍帯ヘルニア」や、超緊急疾患である「腸回転異常症(からの軸捻転)」を引き起こす。
消化管の発生は、単なる暗記じゃなくて、一つのダイナミックな「物語」として理解することが重要です。この流れが頭に入っていれば、解剖も臨床も、ずっと理解しやすくなるはずです。
(Gemini 2.5 Pro)
生理的臍帯ヘルニア physiological umbilical hernia/physiological midgut herniation 消化管の回転
ヒトの発生過程で起こる「生理的臍帯ヘルニア」について解説しますね。
これは、胎生期(受精〜8週末)の終わりごろに、中腸(消化管の一部)が急速に成長するため、一時的に腹腔(お腹の中)に収まりきらず、臍帯(へその緒)の付け根部分に飛び出す正常な現象です。
タイミング (時期)
カーネギーステージ (CS)
生理的ヘルニアが始まるのは、CS 14〜16 ごろです。
腸管ループが最も顕著に飛び出している(ヘルニアがピークになる)のは、CS 17〜23(胎生期の終わり頃)にあたります。
受精後の日数
受精後でいうと、以下のようになります。
- ヘルニアの開始: 受精後 約6週 (約40日ごろ) から腸管が腹腔外へ脱出し始めます。
- ヘルニアのピーク: 受精後 8〜9週 ごろに最も大きくなります。
- ヘルニアの解消 (還納): 受精後 10〜12週ごろ にかけて、腸管は腹腔内に戻り、ヘルニアは自然に解消されます。
理由・意義・メカニズム (なぜ?)
これらは密接に関連しています。
1. 理由:スペース不足 (Why?)
最も直接的な理由は「腸管の急激な成長 vs 腹腔の狭さ」です。
- 腸の急成長: この時期、中腸(将来の小腸の大部分と大腸の半分)は、栄養吸収面積を増やすために非常に急速に長く伸びます。
- 肝臓の巨大化: 同時に、胎児の造血(血液を作る)機能は主に肝臓が担っているため、肝臓が体に対して不釣り合いなほど巨大化しています。
- 結果: 小さな腹腔は、「巨大な肝臓」と「急成長する腸」を同時に収容できません。行き場を失った腸管ループが、抵抗の最も少ない場所、つまり臍帯の内部(体外腔)へと一時的に「避難」します。
2. 意義・目的:腸管の回転 (Purpose?)
単に避難するだけが目的ではありません。この腹腔外にいる期間を利用して、消化管が最終的な正しい配置になるための**重要な「回転」**が行われます。
- 270度の反時計回り回転:
- 中腸ループは、上腸間膜動脈 (SMA) という動脈を「軸」にして、合計270度、反時計回りに回転します。
- この回転は、ヘルニアが起こる際にまず90度、そして腹腔内に戻る(還納する)際(10週ごろ)にさらに180度回転します。
- 回転の目的: この複雑な回転によって、十二指腸がC字型に固定され、盲腸(やがて虫垂ができる場所)が左上から右下へ移動し、最終的に右下腹部に固定されます。また、上行結腸、横行結腸、下行結腸が解剖学的に正しい位置(お腹の「枠」を作るような配置)に収まります。
うまくいかなかった場合 (病態)
この生理的ヘルニアの一連のプロセス(脱出・回転・還納)が正常に完了しないと、先天的な異常(病気)につながります。
1. 腸管が戻らない場合 → 臍帯(さいたい)ヘルニア (Omphalocele)
受精後12週を過ぎても腸管が腹腔内に戻らず、臍帯の付け根に脱出したままの状態で生まれてくる病気です。
脱出した腸管は、羊膜や腹膜(臍帯を構成する膜)によって覆われているのが特徴です。他の臓器(肝臓など)も一緒に脱出することがあります。
2. 回転がうまくいかない場合 → 腸回転異常症 (Intestinal Malrotation)
腸管は腹腔内に戻ったものの、上記の「270度の反時計回りの回転」が正常に行われなかった状態です。
- 症状: 回転が不完全だと、腸を固定する「腸間膜」の根元(付着部)が短く狭くなってしまいます。
- 危険性: 腸がうまく固定されていないため、腸全体がねじれやすい状態(不安定)になります。これがねじれると**「中腸軸捻転(腸捻転)」**を引き起こします。
- 中腸軸捻転 (Volvulus): 腸がねじれることで、腸自身への血流(上腸間膜動脈)が止まってしまい、腸が広範囲に壊死する可能性のある、新生児期〜乳児期の緊急疾患です。
まとめ
生理的臍帯ヘルニアは、狭い腹腔で効率よく内臓(特に腸)を発生・配置させるための、非常にダイナミックで合理的な「正常な発生プロセス」です。このプロセスが失敗すると、重篤な外科的疾患につながるため、発生学的に非常に重要なイベントとされています。
(Gemini 2.5 Pro)
3D Midgut Embryology – Rotation of Midgut in 3D – Physiological Umbilical Hernia and Intestines MedicoVisual – Visual Medical Lectures チャンネル登録者数 7.29万人
上の説明では、ヘルニアが引っ込むところは180回転とはかぶせてませんでした。2つの変化を同時に見せるとわかりにくいからとのことです。下の動画では、引っ込むときに180度動くことをアニメーションで示しています。
Embryological Rotation of the Midgut Ali N チャンネル登録者数 2320人
下の動画を見ると、中腸が90度回転、180度回転、さらに大腸がぐるっと動いてで成体の腸管の配置になるっているみたいです。再生が1倍だと理解がおいつかないので、0.25x倍くらいに遅くして何回も見てみると、だんだん分かってきます。
New Revelations in the Pathophysiology and Surgical Management of Congenital Gut Malrotation Cleveland Clinic チャンネル登録者数 69.7万人
下の動画も、大腸と小腸の最終的な位置関係が決まる様子などが、簡潔な説明でわかりやすいと思いました。
Rotation of the midgut bobacland チャンネル登録者数 8630人
- ヒト胚子期で起こる生理的臍帯ヘルニアと肝臓形態形成の関連性 https://pfwww.kek.jp/acr/2019pdf/u_reports/pf19b0062.pdf 肝臓が形成されないような例でも、ヘルニアは正常に起きたことから、従来から言われているような、肝臓が場所を占有して体外に押し出されるという説明には根拠がないという結論。
ヒトはいつからヒトの形になるのか?
32日目(カーネギーステージ14)になると、上肢(将来の腕)、下肢(将来の足)の「芽」が生えてきており、心臓もあり、脳の部分もはっきりできていて、人間らしい形になっています。あとで消失しますが、この時期にはまだ尻尾があります。
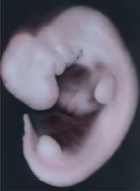 Moore The Developing Human 10th (2016) p77-82 (Letcurioの画面より)
Moore The Developing Human 10th (2016) p77-82 (Letcurioの画面より)
下のウェブサイトには様々な写真があり、どの部分が何かという注釈もついていてわかりやすいです。胎児の周りの広い空間はchorionic sac (絨毛膜腔)です。amniotic sac(羊膜)は、この写真では胎児をぴったりと覆うように位置しています。
 https://embryology.med.unsw.edu.au/embryology/index.php/Carnegie_stage_14
https://embryology.med.unsw.edu.au/embryology/index.php/Carnegie_stage_14
- 生理的臍帯ヘルニア
Adobe Creative Suite 6 Master Collectionはもう必要ない?
プロンプト:Adobe Creative Cloud Proにサブスクしてるんだけど、ってことは、Adobe Creative Suite 6 Master Collectionはもう必要ないよね。
ChatGPT5:
そうですね、その通りです ✅
結論:
Adobe Creative Cloud(特に All Apps や Creative Cloud Pro)を契約しているなら、Adobe Creative Suite 6 Master Collection(CS6)を保持する必要は基本的にありません。
💡 理由
- ソフトの世代がまったく違う
- CS6(2012年発売)は永続ライセンス版、つまり買い切りの最終世代。
- Creative Cloudはサブスクリプション型で、常に最新のPhotoshop、Illustrator、Premiere Proなどが使えます。
- OSとの互換性の問題
- CS6はmacOS Catalina以降(64bit化以降)では起動すらできません。
- Windowsでも動作保証外で、フォントやGPU関係で不具合が多発します。
- 機能・性能差
- CC版はAI補正、クラウド同期、Adobe Fonts、Firefly生成AIなどが統合されており、CS6とは別次元の機能性です。
- ファイル形式もCCで進化しており、CS6では開けないことも。
- ライセンス管理のシンプル化
- CS6のアクティベーションサーバーは2023年時点ですでに停止済み。
- 今後再インストールやPC移行時に認証できない可能性が高いです。
⚠️ ただし残してもいいケース
以下のような限定的な理由があるなら、削除せずアーカイブしておく価値はあります:
- 古いプロジェクト(特に印刷業・DTP系)でCS6のファイルを再現する必要がある。
- プラグインやスクリプトがCS6専用で、CC版で動かない。
その場合は、仮想環境(Windows 10 32bitなど)に隔離して保存するのが安全です。