活性化酸素種(ROS)とは
活性化酸素種( reactive oxygen species; ROS) は、酸素原子を含む反応性の高い化合物の総称です。
通常、三重項酸素が励起してできる一重項酸素(1O2)、酸素が一電子還元された超酸化物スーパーオキシド(O2–)、スーパーオキシドが不均化して生じた二電子還元種である過酸化水素(H2O2)、過酸化水素より生成するヒドロキシラジカル(HO・)の4つを指します。(’活性酸素(かっせいさんそ) e-ヘルスネット 厚生労働省)
活性酸素種(ROS)の種類の覚え方
活性酸素種(ROS)という言葉は、日常的に非常によく目にする言葉ですが、一重項酸素、スーパーオキシド、過酸化水素、ヒドロキシラジカルの4つが活性酸素種(ROS)と呼ばれると言われても互いの関係がわかりにくいと思います。
活性酸素「種」というくらいなので、種類がたくさんあることが理解しにくい原因です。しかし、酸素分子O2がどの程度還元されたか(電子をいくつもらったか)という段階で分けて考えるとすっきりと頭の整理ができます。
そもそも糖が解糖系でピルビン酸にまで酸化され、ピルビン酸がクエン酸回路で酸化されてNADHやFADH2が作られて、NADHやFADH2が電子伝達系でさらに酸化されて、最後は複合体IVでチトクロームcが酸素分子に電子を4つ渡すことで、糖の酸化が簡潔します。1分子の酸素O2が、4つの電子を貰って完全に還元されることが大事で、中途半端な個数の電子を貰って、中途半端に還元された状態がROSということになります。
- Stryer Biochemistry 8th edition Chapter 18 Oxidative Phosphrylation page 538 (or, page 571/1227 (PDF)). Toxic derivatives of molecular oxygen such as superoxide radicals are scavenged by protective enzymes のセクション The transfer of four electrons leads to safe products (two molecules of H2O), but partial reduction generates hazardous compounds. in particular, the transfer of a single electron to O2 forms superoxide ion, whereas the transfer of two electrons yields peroxide.
まず酸素が水になるのは、酸素が完全に還元された状態です。「還元される=電子をもらう」が定義でした。酸素分子O2が、電子を1個ずつもらう(還元される)ステップで考えます。
「電子を1つ貰う」=「e- + H+ をセットでもらう」の意味です。
- 酸素分子 O2
- スーパーオキシド ・O2 ー + H+ (酸素分子O2が、電子をひとつ貰った)
- 過酸化水素 H2O2 (スーパーオキシドが電子を一つもらった。もとのO2で考えると、電子を2つもらった)
- ヒドロキシラジカル ・HO (過酸化水素が電子を一つもらった。もとのO2で考えると、電子を3つもらった。2つ貰ったらH2O(完全に還元)ができて、のこりがヒドロキシラジカル)
- 水 H2O (ヒドロキシラジカルが電子を1つもらた。もとのO2から考えれば電子を合計4つ貰った。もとから考えればH2O分子が2つできたことになります。)
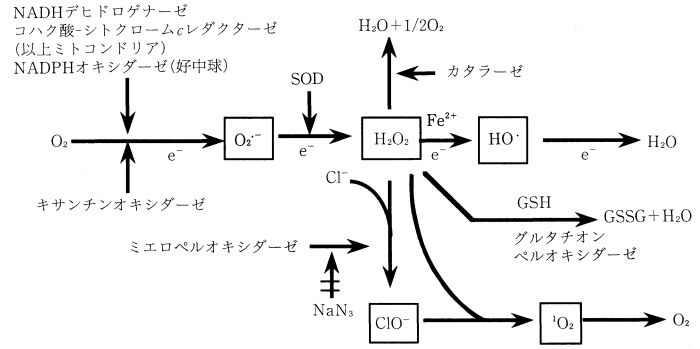
(生体における活性酸素フリーラジカルの産生と消去 図1 より)
参考記事
- 最近よく耳にする活性酸素とは: 岡山理科大学
- 生体における活性酸素フリーラジカルの産生と消去 (PDF) 今田 伊助, 佐藤 英介, 井上 正康 大阪市立大学医学部
次亜塩素酸 hypochlorous acid について
「次亜塩素酸」という単一の物質名が書かれた水溶液は、しばしば pH が異なりしかも pH の違いによって殺菌に要する時間が数十倍となる 11) ことがあるため、市場に混乱を生じさせる要因となっている。pHの違いによって殺菌効果の差は、次亜塩素酸の性質である、非解離の次亜塩素酸(HClO)とプロトン(H+)が解離した次亜塩素酸イオン(ClO-)との間の平衡が大きく影響している(式 2)11-13)。
𝐇𝐂𝐥𝐎 ⇄ 𝐇+ + 𝐂𝐥𝐎− ········· (式 2)
非解離の次亜塩素酸のほうが、解離型の次亜塩素酸イオンよりも殺菌効果が高く、Marks は pH
に依存した非解離の次亜塩素酸の濃度のみが殺芽胞速度に影響すると報告している 14)。https://www.thcu.ac.jp/uploads/imgs/20200622122100.pdf
Marks HC, Wyss O, Strandskov FB. Studies on the Mode of Action of Compounds Containing Available Chlorine. J Bacteriol. 1945 Mar;49(3):299-305. doi: 10.1128/jb.49.3.299-305.1945. PMID: 16560921; PMCID: PMC374040.
次亜塩素酸も活性酸素種の一つとされるようです。
次亜塩素酸の殺菌効果は,活性酸素ラジカル種の一つであるヒドロキシルラジカル(・OH)によるタンパク質,核酸の分解・変性によるものであると報告されている https://www.jstage.jst.go.jp/article/electrochemistry/73/11/73_962/_pdf
好中球にはミエロパーオキシダーゼという酵素が大量に存在し、活性酸素の一種である過酸化水素を塩素イオンと反応させ次亜塩素酸を作り出すからです。なぜ好中球は次亜塩素酸を発生させるこの酵素を大量に有しているか考えたとき、理由はまさに「除菌作用の為」と言えます。https://www.disolva.jp/space/shikumi.html
- 生体における活性酸素フリーラジカルの産生と消去 今田 伊助, 佐藤 英介, 井上 正康 大阪市立大学医学部 https://www.jstage.jst.go.jp/article/kagakutoseibutsu1962/37/6/37_6_411/_pdf
- Sin-Yi Liou, Michael C. Dodd, Evaluation of hydroxyl radical and reactive chlorine species generation from the superoxide/hypochlorous acid reaction as the basis for a novel advanced oxidation process, Water Research, Volume 200, 2021, 117142, ISSN 0043-1354, https://doi.org/10.1016/j.watres.2021.117142.
亜塩素酸について
亜塩素酸(HClO₂)の活性分子種は、塩素過酸化ラジカル(ClOO・)であるということが、最近の研究によって分かり https://www.sankei-group.com/corp/products/asui/
酸素分子の性質
- 基礎無機化学第13分子構造と結合(回V)分子軌道法(I):分子軌道法の基礎と二原子分子 molecularscience.jp ペアを作っていない電子(不対電子)を2つもち,このスピンが磁性を示す.(液体酸素は磁石にくっつく)
- 酸素分子の電子配置 かがくののおと 8 軌道に1つしか電子が入っていないとき,その電子をラジカルとよぶ.ラジカルは,普通は反応中間体のような,不安定な分子に現れ,反応性が高い.酸素分子はいろんな反応をしやすい.
電子のスピンの多重度とは
電子の多重度Mは、
M=1+2∑s(ただしsはスピン量子数で1/2か-1/2をとる)
で定義され、M=1のときを一重項状態、M=3のときを三重項状態と呼ぶそうです。電子が軌道間を遷移する場合は、多重度が変化することは通常許されない(=低い確率でしか起きない)という原理が、蛍光と燐光の違いを生み出しています。一重項励起状態から一重項基底状態に遷移する場合に起こる発光が蛍光です。一重項励起状態から系間移動で三重項励起状態に移りそこから一重項基底状態に遷移する場合に起こる発光が燐光です。蛍光は許容遷移のためミリ秒より短い時間で起きるのに対し、燐光は禁制遷移のため遅く、ミリ秒より長い時間で起きるのだそう。下のリンクの説明が非常にわかりやすかったです。
- 一重項、三重項有機分子の発光の物理 電光石産小さな石たちの物語-半導体のお話
- 多重度 (化学)(ウィキペディア) 多重度は、全スピン角運動量をSとしたとき、2S+1で定義される。全ての電子が対になっている場合はS = 0で、多重度は1である。この場合は一重項(singlet)と呼ばれる。分子が1個の不対電子を有している場合はS = 1/2で、多重度は2S + 1 = 2(二重項、doublet)である。不対電子が2個の場合は同様に三重項(triplet)と呼ばれる。
三重項(トリプレット)酸素
基底状態の酸素分子は三重項酸素と呼ばれ、3O2で表される。これは2つ存在するπ*2p軌道を1個ずつの電子が占有しており、全スピン量子数が1の状態(一重項酸素 ウィキペディア)
偶数個の電子をもつ原子,分子において,電子の多重度D=2S+1=3となるような,スピン量子数S=1の状態(三重項状態 コトバンク)
三重項(基底状態)、一重項(励起状態)のうちのΔ状態と、Σ状態を説明する下図がわかりやすいです。
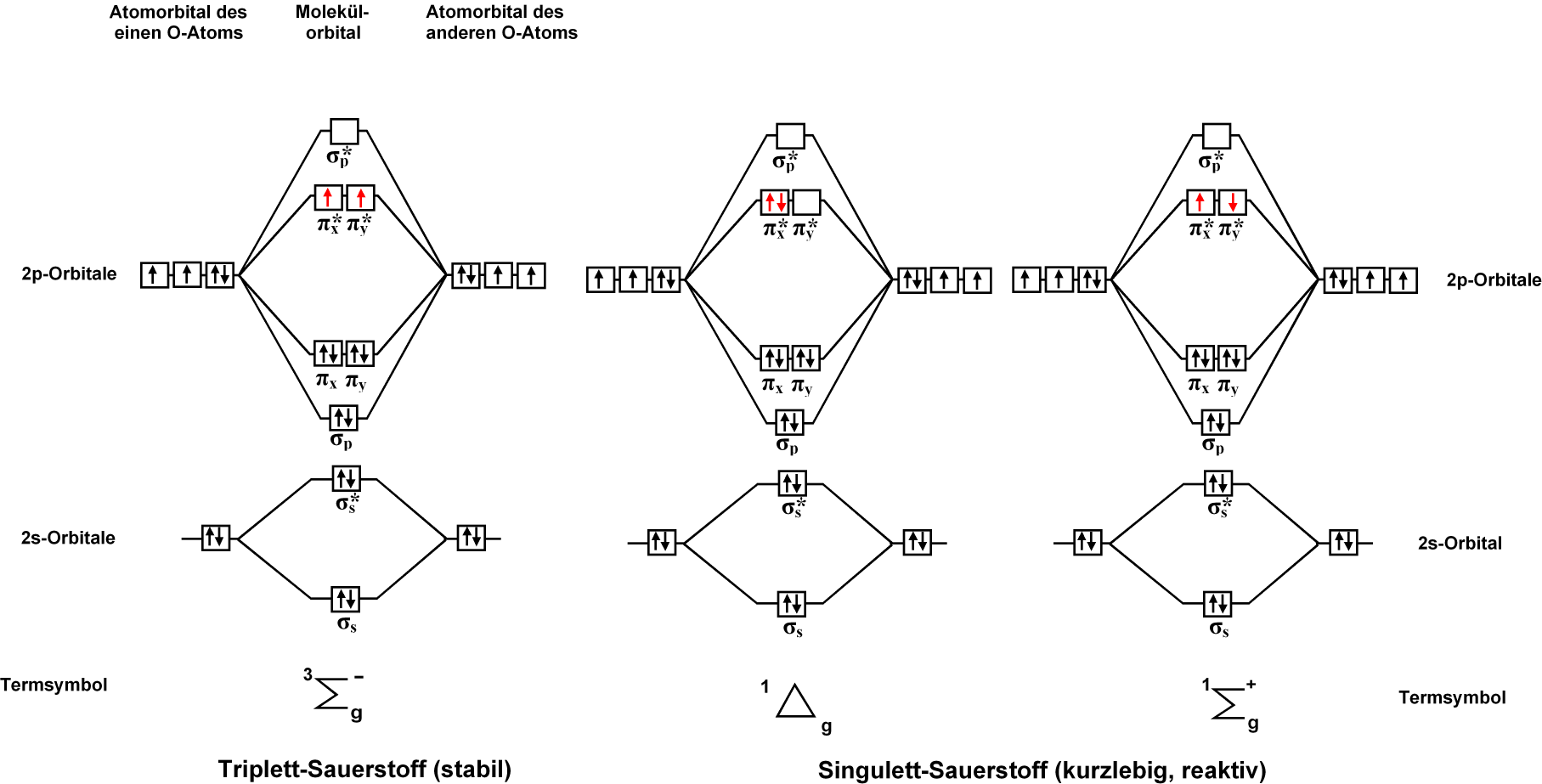 (画像:CC BY-SA 3.0 Molekülorbital-Sauerstoff.png)
(画像:CC BY-SA 3.0 Molekülorbital-Sauerstoff.png)
- 一重項酸素 Singlet Oxygen けむすて
- 一重項と三重項とは 物理のかぎしっぽ
三重項酸素は、軌道に電子が単独で存在する状態なのでフリーラジカル。2つの不対電子を有するのでビラジカルと呼ばれる。ただし、三重項分子は一般的に一重項である有機化合物(生体分子を含む)と反応しないのだそう。
- 三重項酸素 薬学用語解説 日本薬学会
一重項(シングレット)酸素
分子軌道の1つπ*2p軌道上の電子が一重項状態(=全スピン量子数が0)で占有されている励起状態。一重項状態は、2つ存在するπ*2p軌道をそれぞれ1個ずつの電子が占有しているΣ状態と、2つ存在するπ*2p軌道の一方のみを2個の電子が占有し、もう一方のπ*2p軌道は空軌道のΔ状態の2種類ある。(参照:一重項酸素 ウィキペディア)
多電子原子や分子の全電子のスピン量子数の和(合成スピン角運動量S)が0である状態.この状態の多重度(2S+1)は1なので,一重項状態といわれる.(一重項状態 コトバンク)
酸素分子は基底状態が三重項状態であり、三重項状態では反応性はあまり高くないのですが、励起状態である一重項酸素分子は、反応性が高く、いわゆる活性酸素の一つです。
- 一重項酸素の研究(活性酸素分子の生成,検出,定量)(akikuchi.ynu.ac.jp)
Δ1状態よりΣ1状態の方がエネルギーが高いため、Σ1状態は速やかにΔ1状態に遷移する。このため一重項酸素といえば通常Δ1状態のものを指す。一重項酸素(Δ1)は活性酸素の一種ではあるが、軌道上に単独の電子を持たず、フリーラジカルではない。(一重項酸素 薬学用語解説 日本薬学会)
ややこしいですね。酸素の基底状態は三重項状態で、フリーラジカルであるが、反応性は高くない。酸素の励起状態は一重項状態で、フリーラジカルではないが反応性が高く、活性酸素種の一つである。とまとめられそうです。
酸素分子の分子軌道に関する参考サイト
- 【分子軌道論】結合性、反結合性軌道の解説と窒素、酸素の分子軌道例 化学徒の備忘録(かがろく)|化学系ブログ
- 酸素分子O2 eng.kagawa-u.ac.jp 酸素原子の1s軌道同士、2s軌道同士および2pz軌道同士から3組のσ-σ*軌道を作り、2px軌道同士および2py軌道同士から2組のπ-π*軌道を作ります。
- 酸素の分子軌道 第一部:化学と物質構造・共有結合 sekigin.jp
分子軌道法に関する参考サイト
- 分子軌道法(ウィキペディア)分子軌道波動関数は、既知のn個の原子軌道の線形結合(重ね合わせ)で表せると仮定する。LCAO(原子軌道の線型結合、Linear Combination of Atomic Orbital)近似と呼ばれる。原子価結合法(1927年)の後、フント、マリケン、スレイター、レナード-ジョーンズらによって開発された。当初は「フント-マリケン理論」と呼ばれていた。
- 原子構造と化学結合 .doshisha.ac.jp
- 分子軌道理論を用いた有機反応機構の考察 園田 高明
- 【量子化学】分子軌道法とエネルギー準位図の書き方をわかりやすく解説 大学生のための量子化学
その他の参考
混乱しやすい概念、関連するトピックなど。
- フロンティア軌道 化学反応における役割 米澤貞次郎
ROSの生理作用
- Circadian Rhythm Connections to Oxidative Stress: Implications for Human Health Melissa Wilking,1 Mary Ndiaye,1 Hasan Mukhtar,1,2 and Nihal Ahmadcorresponding author1,2,3 Antioxid Redox Signal. 2013 Jul 10; 19(2): 192–208. PMCID: PMC3689169 doi: 10.1089/ars.2012.4889