ユビキチン化は、タンパク質分解の仕組みだと覚えていたのですが、話はそう単純ではなくて蛋白質分解以外の役割も新たに見つかってきて、だいぶややこしい話になっています。
ユビキチン化の生理作用の多様性の発見
ユビキチンによるタンパク質の翻訳後修飾は、プロテアソーム依存的な分解だけでなく、シグナル伝達やDNA修復、タンパク質の輸送、さらにはオートファジー・リソソーム系による分解など広汎な生命機能を制御することが明らかになってきた。(ユビキチンに関する研究 蛋白質代謝プロジェクト)
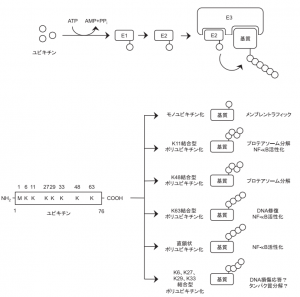
ユビキチン化を司る酵素E1,E2,E3の多様性
ユビキチン修飾系は、E1(ユビキチン活性化酵素)、E2(ユビキチン結合酵素)、E3(ユビキチンリガーゼ)の3種の酵素活性を介して、標的タンパク質のLys残基側鎖に8.6kDaの低分子量球状タンパク質であるユビキチンをイソペプチド結合的に付加する翻訳後修飾系です。ヒトには2種のE1、約50 種のE2、約600種のE3が存在し、E3がユビキチン化すべき標的タンパク質を時空間特異的に識別するという最も重要な役割を担っています。(大阪市立大学 研究内容)
E1,E2,E3の役割の説明がわかりやすい図。一番大事なのはE3で、E3が基質特異性を発揮すると同時にE2に結合しているユビキチン(Ub)を標的タンパク質に転移します。
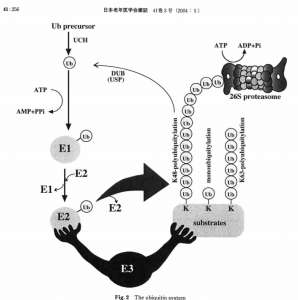
(図の転載元:老年医学の展望 ユ ビキチ ンシグナ リングとその生物学的意義)
E3ユビキチンリガーゼの例:パーキン
ユビキチン化された標的タンパク質は、通常は分解されるわけですから、E3の役割は、ゴミとなったものに「ゴミ」とタグ付けするようなものでしょう。もしE3が突然変異などにより機能しなくなってしまうと、そのE3の役割分担になっていた標的がゴミ化したときにゴミとして捨てることができなくなり、そのゴミが細胞内に蓄積してしまって障害を生じることになります。
E3は標的特異性があることから、標的の数だけE3にも種類があります。パーキンソン病の原因遺伝子であるパーキンparkinと言うタンパク質は、E3ユビキチンリガーゼの一種で、その標的なミトコンドリアのタンパク質です。パーキンに変異があって機能しなくなると、ミトコンドリアタンパク質のゴミとなったものが溜まってしまい、ミトコンドリアが機能できなくなってしまいます。
ユビキチン鎖の構造の多様性と生理作用の多様性との対応関係
生化学 第85巻 第6号,pp.405―413,2013 ポリユビキチン鎖を標的とした NF-κB の新たな調節機構 に、ユビキチン鎖の多様性とその生理作用がわかりやすくまとまっていました。
新学術領域研究ユビキチンネオバイオロジー(H24~H28年度)という新学術領域研究があったくらいに、ユビキチンの構造と機能の多様性は奥が深いです。このサイトにある、図1.ユビキチン修飾の構造多様性と機能 (2017年現在)もわかりやすい。
ユビキチン研究のためのツール
- 各種ポリユビキチン鎖 フナコシ
参考
- 分岐型ユビキチン鎖とアセチル化ユビキチン Journal of Japanese Biochemical Society 92(1): 57-63 (2020) doi:10.14952/SEIKAGAKU.2020.920057